Galicia. Examen PAU resuelto de Química. Junio 2024
PREGUNTA 8
De una disolución 4,0 M de hidróxido de magnesio se toman 50,0 mL y se diluyen con agua hasta un volumen final de 250 mL. A continuación, se usan 15,0 mL de esta disolución para valorar 20,0 mL de una disolución de ácido clorhídrico.
8.1. Escriba la reacción que tiene lugar y calcule la molaridad de la disolución del ácido.
8.2. Describa el procedimiento que emplearía para llevar a cabo la valoración indicando el material necesario.
8.1. La reacción que tiene lugar es la siguiente:
.png)
A partir de la cantidad de hidróxido de magnesio, calculamos los moles de ácido clorhídrico que se necesitan para neutralizar la base:
![]()
Por último, con los moles y la concentración calculamos el volumen:
![]()
8.2. El material y reactivos necesarios para la práctica son:

Procedimiento:
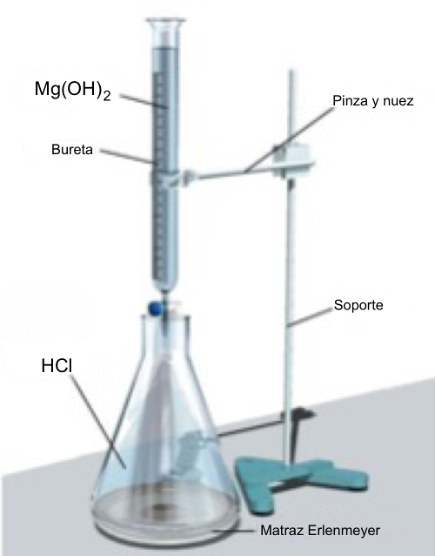
Se mide de forma precisa (con una pipeta o una probeta) el volumen de disolución problema que queremos valorar, la de ácido clorhídrico, y lo ponemos en un Erlenmeyer al que le añadimos unas gotas de fenolftaleína. En una bureta ponemos la disolución patrón, la de hidróxido de magnesio, de concentración conocida, que vamos a utilizar como agente valorante (reactivo). Añadimos lentamente el reactivo sobre la disolución problema hasta que el indicador cambie de color (al principio, en medio ácido, es incoloro y después cambia, en medio básico, a un color rosado). Anotamos el volumen gastado.
Repetimos tres o cuatro veces la experiencia y tomamos como volumen gastado la media aritmética de los tres o cuatro valores obtenidos. En este caso nos daría un volumen de 50 mL.
El dibujo del montaje sería: