Masa molecular de un compuesto orgánico
16. Determina la fórmula empírica y la fórmula molecular de un compuesto orgánico que contiene carbono, hidrógeno y oxígeno, sabiendo que: en estado vapor 2 g del compuesto, recogidos sobre agua a 715 mmHg y 40 0C, ocupan un volumen de 800 mL; y que, al quemar completamente 5 g del compuesto, se obtienen 11,9 g de dióxido de carbono y 6,1 g de agua. La presión de vapor del agua a 40 0C es de 55 mmHg.
La reacción de combustión que se produce será:
.png)
Necesitamos saber cuántos de esos gramos de CO2 son de carbono y cuántos de esos gramos de H2O son de hidrógeno, porque el carbono del CO2 y el hidrógeno del H2O provienen ambos del compuesto que quemamos. Esto lo calculamos con la masa de los elementos con respecto a la masa molecular del compuesto, es decir:
![]()
![]()
Como teníamos 5 g del compuesto orgánico y calculamos la cantidad de carbono y de hidrógeno que tenía, la cantidad de oxígeno será la diferencia:
![]()
Con estos datos podemos calcular la fórmula empírica:
![]()
![]()
![]()
![]()
La fórmula empírica del compuesto es: ![]() .
.
Para calcular la fórmula molecular necesitamos la masa molecular del compuesto. La podemos calcular si suponemos que el vapor del compuesto tiene un comportamiento ideal. Además cuando recogemos este gas sobre agua, el vapor recogido se encuentra mezclado con vapor de agua, por lo que la presión total es igual a la presión parcial del gas más la presión parcial del vapor de agua:
![]()
![]()
![]()
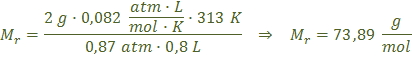
La fórmula molecular es un múltiplo entero de la fórmula empírica:
![]()
La fórmula molecular coincide con la empírica: ![]() .
.

