Geometría de la molécula
13. Para las siguientes moléculas en estado gaseoso: ![]() . Indica razonadamente:
. Indica razonadamente:
a) Número de pares electrónicos en el entorno del átomo central.
b) Número de pares enlazantes y no enlazantes (libres).
c) Geometría de la molécula.
Al igual que en los ejercicios anteriores, vamos a calcular el número de pares electrónicos enlazantes y antienlazantes, lo que nos permite dibujar la estructura de Lewis de las moléculas. A partir de esa estructura, podemos contestar directamente los primeros dos apartados del ejercicio.
La estructura de Lewis del agua sería:
![]()
![]()
![]()
![]()
.png)
La estructura del dicloruro de berilio es:
![]()
El berilio es un elemento que nunca cumple la regla del octete. Tiene dos electrones de valencia y los comparte, por lo que, al final tiene a su alrededor cuatro electrones.
![]()
![]()
![]()
![]()
Por último, la estructura del tricloruro de boro es:
![]()
El boro es otro elemento que nunca cumple la regla del octete. Tiene tres electrones de valencia y los comparte, por lo que, al final tiene a su alrededor seis electrones.
![]()
![]()
![]()
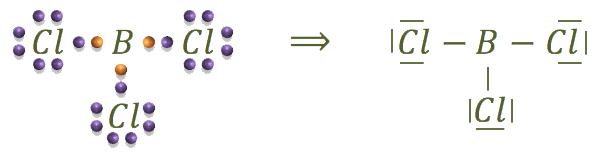
a) Vistas las estructuras de Lewis de cada molécula el número de pares electrónicos alrededor del átomo central son:
Agua: 4 pares electrónicos.
Dicloruro de berilio: 2 pares electrónicos.
Tricloruro de berilio: 3 pares electrónicos.
b) El número de pares electrónicos enlazantes y antienlazantes es:

c) A partir de los pares electrónicos enlazantes y los no enlazantes y utilizando la Teoría de Repulsión de los Pares Electrónicos de la Capa de Valencia (TRPECV), podemos predecir la geometría de estas moléculas. Según este modelo la geometría de una molécula depende de la repulsión electrostática de los pares de electrones alrededor del átomo central. De forma que, la molécula adoptará una forma para que estos pares electrónicos estén lo más separados posible para que las repulsiones entre ellos sean menores.
Según esta teoría la molécula de agua tendrá una geometría angular ya que los dos pares antienlazantes ejercen repulsión sobre los enlazantes y la molécula se curva.
.png)
El dicloruro de berilio no tiene pares electrónicos antienlazantes, por lo que la molécula tiene una geometría lineal.
.png)
Por último, los electrones del tricloruro de boro se distribuyen, para que la repulsión entre ellos sea mínima, dirigidos hacia los vértices de un triángulo equilátero. Como no tiene pares electrónicos no enlazantes, la geometría será plana triangular.
.png)

